Sclerosi multipla e natalizumab
Informazioni utili
Indicazioni: natalizumab è indicato come monoterapia disease-modifying in adulti con sclerosi multipla recidivante remittente ad elevata attività nei seguenti gruppi di pazienti:
• persone con un'elevata attività della malattia nonostante un ciclo terapeutico completo e adeguato con le terapie immunomodulanti di prima linea attualmente approvate per la SM RR;
oppure
• persone con sclerosi multipla recidivante remittente grave ad evoluzione rapida, definita da due o più recidive disabilitanti in un anno e con 1 o più lesioni captanti Gadolinio alla RM cerebrale o un aumento significativo del carico lesionale in T2 rispetto ad una precedente RM effettuata di recente.
Effetti collaterali comuni: reazioni allergiche al momento dell’infusione, maggior rischio di sviluppare infezioni (soprattutto urinarie e a livello delle prime vie aeree), possibili alterazione di alcuni parametri ematochimici (in particolare il numero di globuli bianchi, globuli rossi, piastrine, o della funzionalità epatica), cefalea, stanchezza, dolori articolari, vomito, orticaria.
Effetti collaterali gravi: leucoencefalopatia multifocale progressiva (PML).
Domande e risposte
Che cosa è natalizumab?
Natalizumab è un anticorpo monoclonale umanizzato, cioè prodotto dal modello animale ma modificato in modo da “assomigliare” ad un anticorpo umano e ridurre dunque il rischio di una reazione immunitaria contro una molecola estranea. L'azione di natalizumab consiste nel bloccare la fuoriuscita dei linfociti T e B dai vasi sanguigni, inibendo il loro ingresso nel tessuto nervoso. Non riuscendo più a giungere “a bersaglio”, il risultato è la protezione della mielina dai danni infiammatori causati dai linfociti autoreattivi. Negli studi effettuati, il farmaco ha dimostrato di avere una buona efficacia sulle ricadute e sulla progressione della disabilità nelle persone con sclerosi multipla recidivante-remittente (RR). Si somministra per via endovenosa, una volta al mese, obbligatoriamente in ambiente ospedaliero. Nel 2023 AIFA ha approvato la rimborsabilità della somministrazione per via sottocutanea.
Natalizumab è disponibile in Italia?
Sì. L’Agenzia Italiana del Farmaco (AIFA), seguendo quanto stabilito dai principali organi di controllo USA (la FDA) nonché europei (EMA) ha autorizzato la rimborsabilità del natalizumab per il trattamento di alcune forme particolarmente resistenti di sclerosi multipla recidivante-remittente (RR). Così come è accaduto in tutte le altre parti del mondo, la legge ha indicato precise indicazioni e limiti nell’utilizzo del natalizumab, così come risulta da Gazzetta Ufficiale n. 292 del 16 dicembre 2006.
Quali precauzioni sono state prese per tutelare la salute delle persone che assumono natalizumab?
Le persone che effettuano la terapia con natalizumab devono essere pienamente informate su indicazioni, controindicazioni e possibili rischi del trattamento e firmare, congiuntamente al medico, la carta di allerta indicante il rischio individuale di PML. Inoltre le linee guida emanate dalle autorità regolatorie prescrivono il monitoraggio con risonanza magnetica con frequenza differente a seconda del rischio individuale del paziente. Questo monitoraggio ha il fine di identificare precocemente l’eventuale comparsa di PML.
Che cosa è la carta di allerta?
È un foglio che contiene importanti dati di sicurezza da conoscere prima della somministrazione del farmaco e durante il trattamento. Questo foglio descrive gli effetti indesiderati che sono stati segnalati durante e dopo l’uso del trattamento. È importante tenere con sé la carta di allerta (ad esempio assieme ai propri documenti di identità) non solo durante il trattamento, ma anche per i sei mesi dopo l’ultima dose, perché possono verificarsi effetti indesiderati anche dopo la sospensione del trattamento.
A chi può essere prescritto?
Il trattamento è stato autorizzato per il trattamento di pazienti con SM recidivante-remittente (RR) che non abbiano risposto ad un ciclo terapeutico “completo e adeguato” con le terapie immunomodulanti di prima linea attualmente approvate per la SM RR, o in alternativa a pazienti anche non precedentemente trattati con farmaci immunomodulanti o immunosoppressori, ma con una forma di SM RR ritenuta dal neurologo curante “a grave e rapida evoluzione”.
Dove può essere somministrato?
La terapia può essere effettuata esclusivamente nei centri già individuati dalle Regioni e già designati per la prescrizione dei farmaci immunomodulanti e immunosoppressori e dotati di requisiti specifici elencati nella “scheda di accreditamento” stabilita dall’AIFA. In particolare i centri sclerosi multipla devono possedere esperienza nella diagnosi, terapia e follow-up dei pazienti con sclerosi multipla e avere la possibilità di eseguire un esame di risonanza magnetica con caratteristiche di urgenza (entro 24-72 ore) nel sospetto di leucoencefalopatia multifocale progressiva (PML).
Quali sono i principali effetti collaterali gravi che sono stati osservati? Che cosa è la Leucoencefalopatia Multifocale Progressiva (PML)?
La leucoencefalopatia multifocale progressiva è una malattia virale dovuta al virus JC che insorge quasi esclusivamente nelle persone che soffrono di grave immunodeficienza. Tale virus è presente nell'86% della popolazione, sebbene rimanga latente nella maggior parte dei casi, e può dare origine alla malattia soltanto nel momento in cui il sistema immunitario sia fortemente indebolito. La leucoencefalopatia multifocale progressiva è caratterizzata da sintomi aspecifici come una maggiore debolezza, da sintomi come disturbi della visione, cambiamenti comportamentali o di personalità, disturbi della memoria e dell’orientamento fino a quadri veri e propri di confusione mentale, crisi epilettiche. Purtroppo al momento non vi sono cure specifiche (antivirali) per questa malattia; tuttavia i sintomi possono migliorare e la malattia può arrestarsi se migliora il sistema immunitario della persona. Se una persona è in trattamento con natalizumab, il sistema immunitario in periferia ha una normale risposta verso le infezioni -è immunocompetente-, ma la terapia blocca l’ingresso nel sistema nervoso delle cellule in grado di contrastare l’infezione da virus JC: si dovrò quindi sospendere il trattamento in corso e eventualmente sottoporre la persona alla plasmaferesi. La prognosi della PML è molto variabile e può causare disabilità di grado estremamente variabile, con quadri clinici da molto lievi a più gravi, ed in alcuni casi la morte. Nel caso di PML che insorge durante trattamento con natalizumab la diagnosi precoce e la sospensione del trattamento sono fondamentali per una migliore prognosi: influenzano infatti in modo significativo sia per il decorso che avrà l’infezione sia per il grado di disabilità che può permane nelle persone - da quadri molto lievi a quadri più gravi.
In che cosa consiste la stratificazione del rischio di sviluppare PML?
La stratificazione del rischio di PML si basa su 3 fattori, associati tra loro:
• Presenza degli anticorpi anti-JCV: le persone che risultano positive alla presenza degli anticorpi anti-JCV sono entrate in contatto con il virus nel corso della loro vita e presentano un rischio maggiore di sviluppare la PML in confronto a quelli che sono negativi alla presenza degli anticorpi anti-JCV (in queste persone il rischio stimato è di 1 caso di PML ogni 10.000 persone trattate con natalizumab). Tuttavia la PML si manifesta solo in una minoranza di pazienti che presentano gli anticorpi anti-JCV perché l’infezione da JCV è solo uno di diversi fattori necessari per lo sviluppo della PML. Il test per verificare la presenza degli anticorpi anti-JCV e misurarne il loro livello (test STRATIFY) è quindi di fondamentale importanza per la valutazione del rischio di PML nelle persone trattate con natalizumab: quando risulta positivo è utilizzato in combinazione con gli altri fattori di rischio per valutare il rischio personalizzato della singola persona.
• Durata del trattamento: nelle persone JCV positive, il rischio aumenta con la durata del trattamento, in particolare dopo i primi 2 anni di terapia.
• Precedente trattamento con farmaci immunosoppressori: le persone che prima della terapia con natalizumab hanno utilizzato farmaci immunosoppressori hanno un rischio più elevato di sviluppare la PML.
Le persone che presentano tutti e tre i fattori di rischio (ovvero sono risultate positive per gli anticorpi anti-JCV, hanno usato in precedenza immunosoppressori e utilizzano natalizumab da più di 2 anni) presentano un rischio più alto di sviluppare la PML.
Nelle persone trattate con natalizumab risultate positive per gli anticorpi anti-JCV ma che non hanno effettuato in precedenza terapia con farmaci immunosoppressori, il livello di risposta anticorpale (index) è associato al livello di rischio di sviluppare la PML (ovvero a livello anticorpale più elevato corrisponde un rischio maggiore). In particolare, il rischio è basso per valori di index pari o inferiori a 0.9 e aumenta notevolmente per valori di index >1,5 nei pazienti trattati con natalizumab per più di 2 anni.
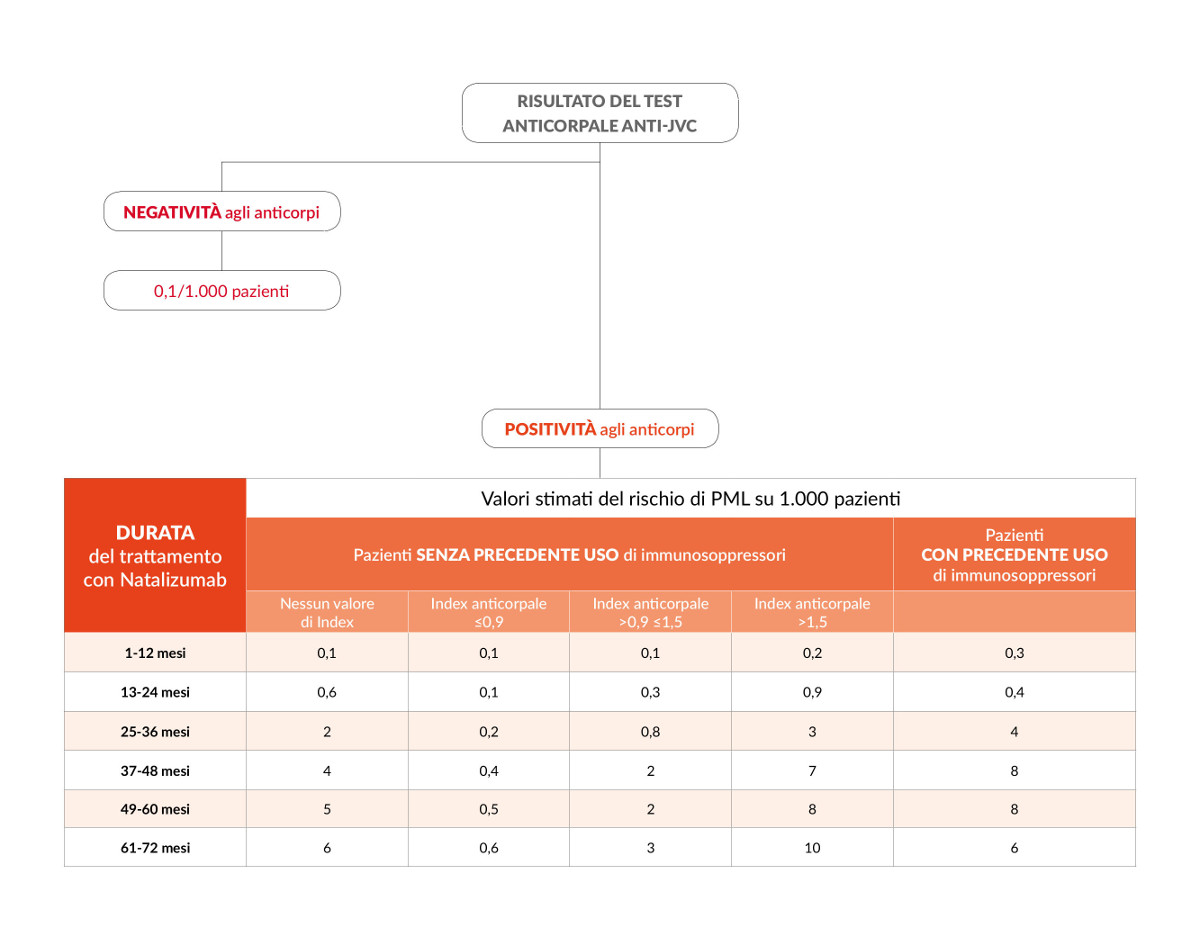
La tabella è tratta dalle linee guida AIFA.
Il 26 febbraio 2016 l’Agenzia Europea del Farmaco ha aggiornato le raccomandazioni per minimizzare il rischio di PML in seguito ad utilizzo del trattamento. In particolare, il Comitato di valutazione dei rischi per la farmacovigilanza (PRAC - Pharmacovigilance Risk Assessment Committee) ha stabilito che per i pazienti con un basso indice di anticorpi (index<1.5) e che non hanno utilizzato farmaci immunosoppressori prima di iniziare natalizumab, si raccomanda di ripetere il test degli anticorpi per il virus JC ogni 6 mesi una volta che hanno assunto la terapia per più di 2 anni. Nei pazienti che sono risultati negativi per gli anticorpi del virus JC, il test degli anticorpi deve essere ripetuto ogni 6 mesi. In qualsiasi situazione in cui si sospetti una PML il trattamento con natalizumab deve essere sospeso fino a quando la PML è stata esclusa.
Quali sono gli effetti collaterali più frequenti?
Al momento dell’infusione o subito dopo la somministrazione possono verificarsi reazioni allergiche, anche gravi (fino al rischio di una vera e propria risposta anafilattica, che, seppur raramente, può risultare mortale). Inoltre, come gran parte dei farmaci “immunologici”, è stata riportata una maggiore facilità a sviluppare infezioni, in genere non gravi (soprattutto urinarie e a livello delle prime vie aeree), e la possibilità di alterazione di alcuni parametri ematochimici (in particolare il numero di globuli bianchi, globuli rossi, piastrine, o della funzionalità epatica). Infine, sintomi frequenti, in genere di scarsa importanza clinica, sono cefalea, stanchezza, dolori articolari, vomito, orticaria.
È controindicata la somministrazione dei corticosteroidi durante l’uso di natalizumab?
Brevi cicli di corticosteroidi (in genere in caso di ricadute) non sono controindicati.
È possibile utilizzare contraccettivi orali in corso di trattamento con natalizumab?
La terapia non interagisce con i contraccettivi orali, e non rappresenta quindi una controindicazione all’uso di questo metodo contraccettivo.
È possibile effettuare vaccinazioni mentre si è in terapia?
La scheda tecnica di natalizumab riporta che non ci sono controindicazioni ad effettuare vaccinazione con vaccini inattivati, mentre non sono disponibili studi sull’uso di vaccini vivi , pertanto se ne sconsiglia l’uso.
Natalizumab può avere affetti negativi su una possibile gravidanza?
In caso di pianificazione di gravidanza è raccomandata una attenta valutazione del profillo rischio/beneficio. In particolare una banca dati tedesca sulla gravidanza e sulla SM non ha rivelato effetti avversi specifici di natalizumab sull'esito della gravidanza dopo esposizione nel primo trimestre. Il tasso di aborto spontaneo, malformazioni, parti prematuri e bambini con basso peso alla nascita è risultato simile tra il gruppo di donne con sclerosi multipla in trattamento con natalizumab e i controlli. Anomalie ematologiche reversibili (anemia e piastrinopenia da lievi a moderate) sono state osservate in alcuni neonati le cui madri hanno ricevuto natalizumab per il trattamento della SM altamente attiva durante il terzo trimestre di gravidanza. Infine in uno studio sulle donne con sclerosi multipla recidivante-remittente condotto dal MS Study Group della Società Neurologica Italiana, l'esposizione a natalizumab è stata associata ad un aumentato rischio di aborto spontaneo rispetto gravidanze di donne con SM che assumevano interferone o non assumevano farmaci. Tuttavia, il tasso di aborto spontaneo è rimasto nel range atteso della popolazione italiana generale.
È possibile allattare durante il trattamento con natalizumab?
I dati indicano che natalizumab viene escreto nel latte materno. L’effetto su neonati/lattanti è sconosciuto. L’allattamento deve dunque essere interrotto durante il trattamento.
Quali studi sono attualmente in fase di realizzazione?
Post-marketing: Allo scopo di confermare nella pratica clinica quotidiana i dati di efficacia e sicurezza ottenuti durante gli studi registrativi anche su periodi di trattamento più lunghi, l'azienda produttrice del farmaco ha realizzato un esteso programma di studi osservazionali post-marketing.
I pazienti trattati con natalizumab sono infatti inseriti nei seguenti principali programmi osservazionali o di monitoraggio:
• Tysabri Outreach: Unified Commitment to Health (TOUCH) e TYsabri Global observational progRam In Safety (TYGRIS), programmi in cui sono stati arruolati 90.038 pazienti alla data del 1 giugno 2017 nel TOUCH e 6508 nel TYGRIS. Trattasi di studi internazionali osservazionali prospettici, che hanno l’obiettivo di acquisire dati clinici relativi agli effetti del trattamento con natalizumab nella pratica clinica con particolare attenzione agli aspetti di sicurezza.
• Tysabri Observational Program (TOP), con 6148 pazienti arruolati alla data del 1 gennaio 2017. Questo studio, che terminerà nel 2028, ha già consentito di raccogliere dati di efficacia e sicurezza di natalizumab in un’ampia popolazione di pazienti con lunga durata di osservazione (pubblicati risultati di 10 anni di osservazione)
• Safety of Tysabri Re-dosing And TreAtment (STRATA, 1094 pazienti arruolati a gennaio 2011). Rappresenta un’estensione degli studi registrativi di fase III i cui risultati ad oggi disponibili dimostrano che l’efficacia ed i benefici clinici del farmaco sono conservati anche nel lungo termine (5 anni), con un profilo di sicurezza sovrapponibile a quello della popolazione generale.
Bibliografia
Linee Guida Tysabri versione 17.
Risk of natalizumab-associated PML in patients with MS is reduced with extended interval dosing. Ryerson et al Neurology 2019. Portaccio et at. Pregnancy decision-making in women with multiple sclerosis treated with natalizumab. Neurology 2018.
Kappos et al. Real-world Data from over 10 Years in the TYSABRI Observational Program: Long-term Safety and Effectiveness of Natalizumab in Relapsing-Remitting Multiple Sclerosis Patients. ECTRIMS 2018.
Foley et al. Long Term Safety of Natalizumab Treatment in MS in clinical practice: results from the Tysabri Global Observational Program in safety (TYGRIS). ECTRIMS 2016.
O'Connor et al. Long-term safety and effectiveness of natalizumab redosing and treatment in the STRATA MS Study. Neurology 2014.
Ultimo aggiornamento 26 luglio 2023

